Учені успішно редагували людський ембріон в лабораторних умовах.
 Видання Nature опублікувало статтю групи південнокорейських і американських вчених: під керівництвом Шухрата Міталіпова, їм вдалося позбавити ембріон людини від гену, що приводить до розвитку важкого захворювання – гіпертрофічній кардіоміопатії. Це не перша спроба редагувати людські ембріони. У червні 2017 року з’явилися результати такої роботи китайських вчених, однак її не можна було назвати особливо успішною. Обидві групи дослідників використовували технологію CRISPR-Cas9, яка дозволяє знайти в ДНК потрібний ген і видалити або підправити його.
Видання Nature опублікувало статтю групи південнокорейських і американських вчених: під керівництвом Шухрата Міталіпова, їм вдалося позбавити ембріон людини від гену, що приводить до розвитку важкого захворювання – гіпертрофічній кардіоміопатії. Це не перша спроба редагувати людські ембріони. У червні 2017 року з’явилися результати такої роботи китайських вчених, однак її не можна було назвати особливо успішною. Обидві групи дослідників використовували технологію CRISPR-Cas9, яка дозволяє знайти в ДНК потрібний ген і видалити або підправити його.

CRISPR – особливі локуси бактерій і архей, що складаються з прямих повторюваних послідовностей, які розділені унікальними послідовностями (спейсерами). Спейсери запозичуються з чужорідних генетичних елементів, з якими стикалася клітина (бактеріофагів, плазмід). РНК, транскрибується з локусів CRISPR, спільно з асоційованими білками Cas забезпечують адаптивний імунітет за рахунок комплементарного зв’язування РНК з нуклеїновими кислотами чужорідних елементів і подальшого руйнування їх білками Cas. Втім, на цей момент є чимало свідчень участі CRISPR в процесах, не пов’язаних з імунітетом.
Використання систем CRISPR-Cas для спрямованого редагування геномів є перспективним напрямком в сучасній генної інженерії. В даний час вчені широко використовують підходи, засновані на системах CRISPR-Cas; можливо, в майбутньому ці підходи будуть застосовувати в медицині для лікування спадкових захворювань.

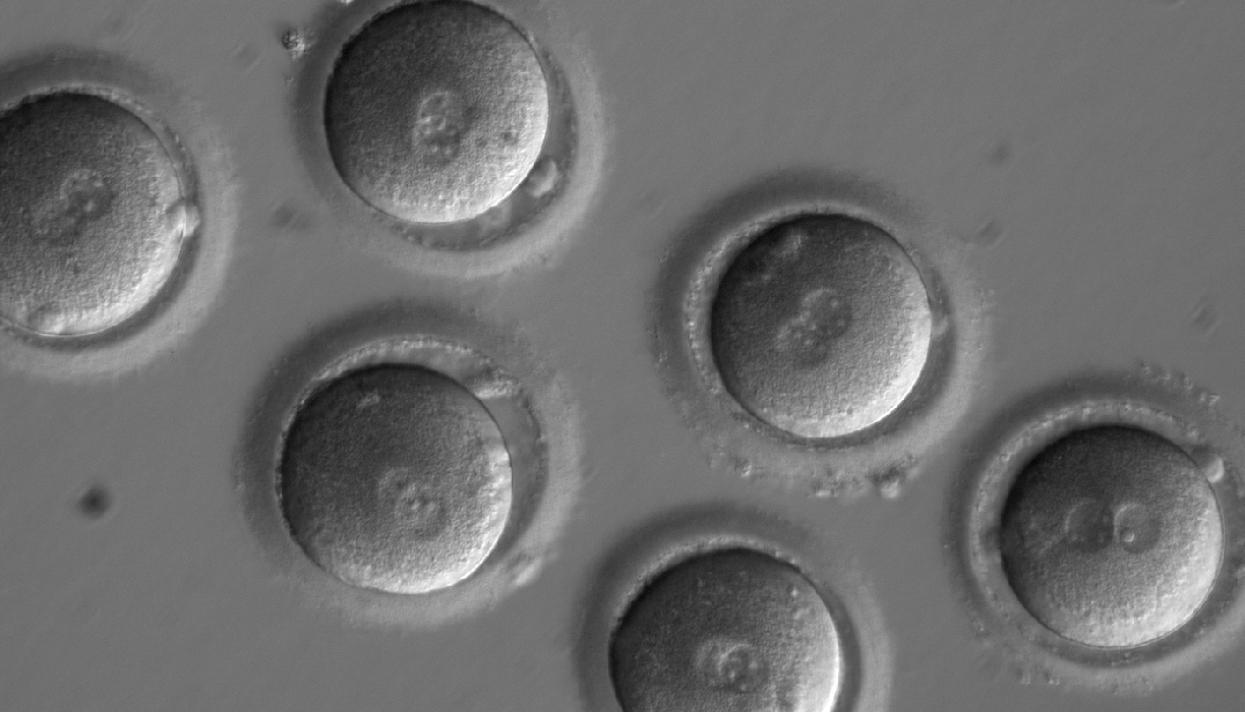
У клітинах нашого тіла містяться по дві копії більшості генів. У людей з гіпертрофічною кардіоміопатією одна копія гена під назвою MUBPC3 нормальна, а інша – з мутацією. У статевих клітинах (сперматозоїдах або яйцеклітинах) залишається тільки одна копія кожного гена. У дослідженні вчені використовували сперму чоловіка з гіпертрофічною кардіоміопатією, і в ній, відповідно, половина сперматазоідов була нормальна, а половина – з мутацією. В результаті 50 відсотків ембріонів, отриманих за допомогою цієї сперми, мали мутантний ген, а інші 50 відсотків – ні. Таким же був би відсоток здорових дітей і дітей з гіпертрофічною кардіоміопатією, народжених від цього чоловіка. Після редагування зигот (запліднених яйцеклітин) здорових ембріонів стало не 50 відсотків, а 72 відсотки. Іншими словами, майже половину зигот з мутацією вдалося відредагувати. Якби пара, в якій один або обидва партнери мають гіпертрофічну кардіоміопатію, вирішила народити дитину без цієї хвороби, редагування сильно б підвищило їх шанси. Процедура б складалася із звичайного екстракорпорального запліднення, але з додатковою стадією редагування, щоб збільшити число ембріонів без мутації.

Автори нової роботи показали, що, якщо вводити в яйцеклітину редактор Cas9 одночасно зі сперматозоїдом, мозаїчність істотно знижується, тобто «виправлений» варіант гена присутній майже у всіх клітинах ембріона.
Ця робота показує, що можна підібрати умови, коли редагування проходить точно. А значить, якщо б з відредагованих ембріонів виросла людина, то він нічим не відрізнявся б від НЕ відредагованого, з тією лише різницею, що у нього або в неї не було б кардіоміопатії, яка гарантовано з’явилася б без редагування.

Якщо ви знайшли помилку, будь ласка, виділіть фрагмент тексту та натисніть Ctrl+Enter.